Una terapia génica experimental logró cambiar el pronóstico de decenas de niños con un trastorno inmunitario poco frecuente y letal. Investigadores de Estados Unidos y Reino Unido trataron con éxito a 59 de 62 pacientes diagnosticados con inmunodeficiencia combinada grave por deficiencia de adenosina deaminasa, conocida como ADA-SCID.
Los resultados muestran que el sistema inmunitario de la mayoría de los pacientes se recuperó por completo y se mantuvo estable con el paso de los años, lo que representa un avance decisivo frente a las terapias existentes, que son costosas, riesgosas y limitadas.
El estudio se desarrolló durante más de una década e incluyó a niños diagnosticados en sus primeros meses de vida. ADA-SCID es una enfermedad genética muy poco frecuente que afecta a entre tres y cinco recién nacidos por millón.

Su origen está en mutaciones que impiden la producción de una proteína esencial para activar los glóbulos blancos, encargados de proteger al organismo frente a virus, bacterias y hongos. Sin esa proteína, los bebés quedan prácticamente sin defensas, lo que los expone a infecciones potencialmente mortales como neumonía, meningitis o varicela. Sin tratamiento, la mayoría no supera los dos años de vida.
La nueva terapia consiste en extraer las células madre sanguíneas de cada paciente, insertar en ellas un virus que lleva una copia sana del gen defectuoso e infundirlas nuevamente en el organismo. Una vez corregidas, esas células producen glóbulos blancos funcionales, capaces de reconstruir las defensas naturales. El procedimiento se aplica una sola vez y, según los especialistas, el sistema inmunitario tarda de seis a doce meses en alcanzar niveles normales.
Entre 2012 y 2019 se trataron 62 niños con esta técnica. Cincuenta y nueve mostraron una recuperación completa y estable de sus funciones inmunitarias, sin efectos adversos graves vinculados al tratamiento. En los tres casos en los que no funcionó, los pacientes pudieron retomar las terapias estándar. La mayoría de los efectos secundarios fueron leves o moderados, asociados a prácticas rutinarias de los hospitales, y no al proceso de modificación genética.
Un tratamiento que cambia la vida de familias enteras
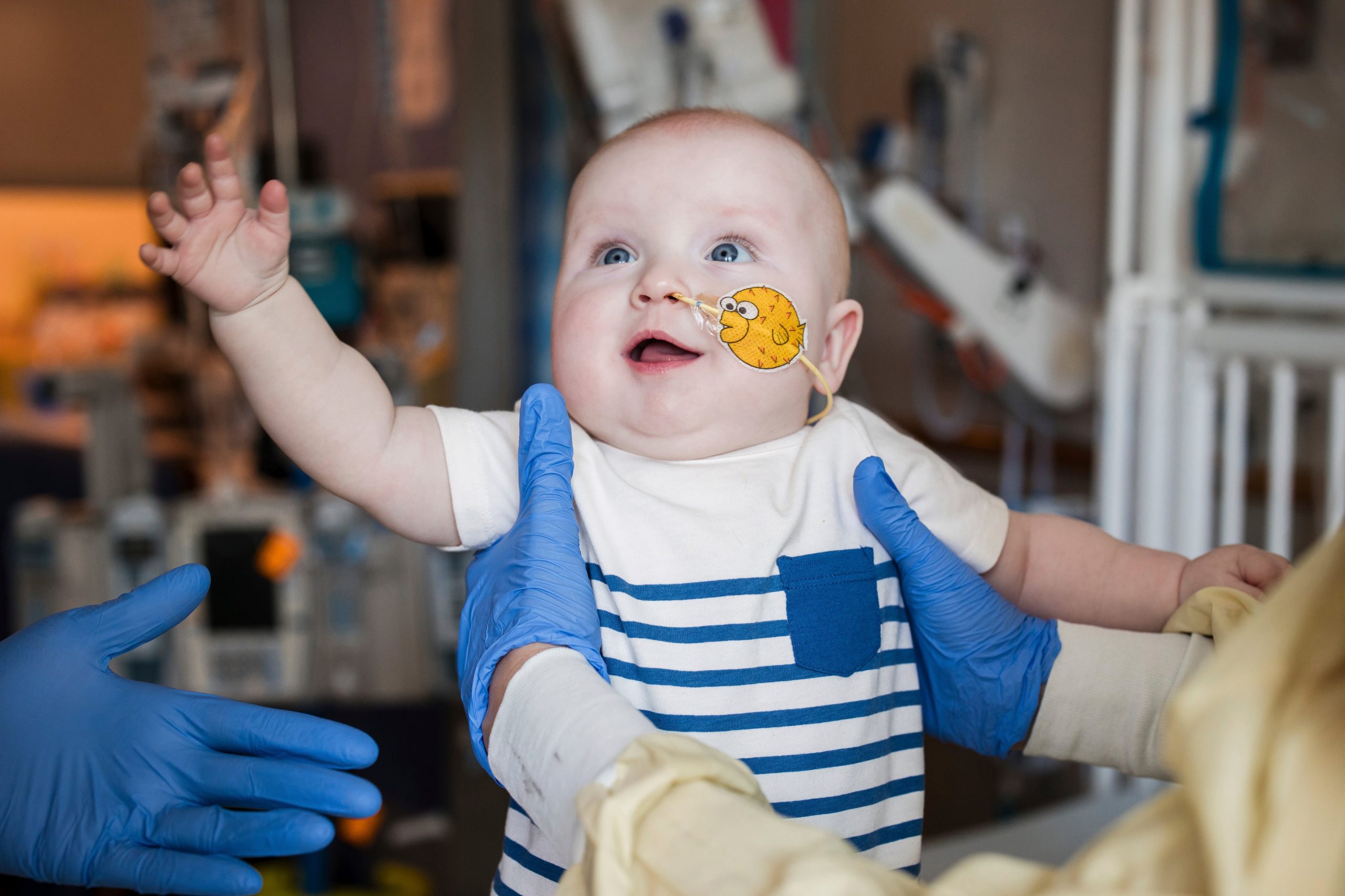
El caso de Eliana Nachem ilustra el impacto que tuvo esta innovación médica. Nació en el estado de Virginia en 2014 y fue diagnosticada a los tres meses. Su familia se vio obligada a transformar su hogar en un refugio hermético para evitar que contrajera cualquier infección. Sus padres despidieron a sus mascotas, instalaron filtros de aire y controlaron al extremo cada objeto que ingresaba en la vivienda. “Todo lo que pudiera albergar gérmenes era peligroso para ella”, contó su madre Caroline.
A los diez meses, Eliana recibió la terapia génica experimental. El procedimiento permitió que su sistema inmunitario se desarrollara y hoy lleva una vida normal. “Recuerdo haber pensado, ha vuelto a nacer, y ahora solo tenemos que verla crecer”, dijo su madre. Su padre Jeff también relató el sacrificio cotidiano que debieron asumir. “Fue muy duro. Nuestra hija Eliana tenía que estar encerrada en casa, así que mi esposa también se aisló del mundo para no arriesgarse a infectarla. Yo tenía que seguir yendo a trabajar, pero al regresar a casa tenía que ducharme y ponerme ropa limpia antes de tocarlas”, recordó desde Nueva York.
Con la terapia, Eliana pudo volver a salir al mundo. “Saca unas notazas en el colegio, juega al baloncesto y hasta se ha apuntado al coro escolar. Es increíble”, resumió Jeff. El caso no es aislado. Todos los niños tratados que respondieron al procedimiento pudieron abandonar el aislamiento extremo que caracteriza a esta enfermedad, conocida popularmente como “síndrome del niño burbuja”, término difundido desde la década de 1970 por la película El chico de la burbuja de plástico, protagonizada por John Travolta.
Un avance que plantea nuevos desafíos médicos y económicos

Donald Kohn, médico de la Universidad de California en Los Ángeles y uno de los líderes del estudio, explicó que es prematuro hablar de curación definitiva. “Para mí, curación significa ausencia de la enfermedad durante toda la vida. Aún no podemos decir eso. Sin embargo, el periodo de observación ya dura entre 7 y 12 años y los beneficios clínicos se han mantenido completamente estables, así que espero que siga siendo así de por vida”, afirmó.
Los resultados fueron publicados en la revista The New England Journal of Medicine y representan uno de los seguimientos más extensos para este tipo de terapias. En cinco pacientes, la recuperación se extendió más allá de la década sin recaídas, un dato clave que consolida la evidencia científica sobre la eficacia a largo plazo.
Hasta ahora, el tratamiento estándar consistía en aplicar inyecciones semanales de la proteína ausente, una solución costosa y limitada que pierde eficacia con el tiempo. Otra alternativa es el trasplante de médula ósea, que requiere encontrar rápidamente un donante compatible y presenta riesgos elevados de complicaciones.
También existe el Strimvelis, una terapia génica desarrollada en Italia y autorizada en Europa en 2016. Este tratamiento también utiliza un virus para introducir el gen sano, pero debe administrarse en Milán con células frescas, lo que obliga a las familias a viajar largas distancias. Además, uno de los pacientes desarrolló leucemia como efecto adverso inesperado, aunque la mayoría tuvo excelentes resultados.
La terapia liderada por Kohn se diferencia por el uso de lentivirus, un tipo de virus que no ha mostrado indicios de provocar alteraciones indeseadas en el ADN. Además, los científicos lograron congelar las células modificadas, un avance logístico crucial. “Esto elimina la necesidad de que los pacientes y sus familias viajen largas distancias a centros especializados”, explicó la doctora Katelyn Masiuk, exlíder del equipo de Kohn. Gracias a esta innovación, el tratamiento podría aplicarse en hospitales de distintas partes del mundo sin necesidad de infraestructuras centralizadas.
Sin embargo, el desarrollo enfrenta desafíos económicos significativos. Kohn explicó que la producción de estas terapias es compleja y requiere instalaciones con atmósferas controladas, personal especializado y estrictos controles de calidad. “No sé cuánto costará cada tratamiento”, admitió. Aunque es caro fabricar cada dosis, las inyecciones tradicionales también representan un gasto elevado durante años, por lo que una terapia única podría resultar más rentable a largo plazo.

En Europa, el precio de este tipo de procedimientos ronda los cuatro millones de euros por paciente, un costo que limita su adopción en sistemas de salud públicos. Muchas farmacéuticas han desistido de desarrollar terapias génicas para enfermedades raras porque los gobiernos no autorizan precios tan altos, explicó Juan Antonio Bueren, investigador del CIEMAT y expresidente de la Sociedad Europea de Terapia Génica y Celular.
“Hay un problema para la comercialización de las terapias génicas para enfermedades raras: su coste ahora mismo es enorme, por el propio coste de producción de los virus y de las células modificadas genéticamente, por el coste de todos los controles que exigen las agencias reguladoras y por el hecho de que los pacientes tengan que ser seguidos durante 15 años”, señaló.
Orchard Therapeutics, que había obtenido la licencia de la terapia en 2016, interrumpió su desarrollo cinco años después por dificultades financieras. Ante la falta de socios, Kohn y dos miembros de su laboratorio fundaron la compañía Rarity PBC para continuar el proyecto y recibieron 13 millones de euros de una agencia californiana para avanzar en la fabricación industrial.
Mientras tanto, las familias siguen viendo en esta terapia una oportunidad única. Jeff Nachem lo expresó con claridad: “No sé cuánto hay que cobrar por ello, pero este tipo de tratamiento no debería negársele a un niño pequeño que lo necesita para sobrevivir”.