En el vasto mapa del cuerpo humano, existen rutas ocultas por donde se deslizan mensajes silenciosos. Los tumores, lejos de ser simples masas de células rebeldes, pueden transformarse en hábiles estrategas: interceptan estas autopistas neuronales y convierten el sistema nervioso en cómplice de su supervivencia.
Un estudio reciente publicado en Nature demuestra que los tumores sólidos en órganos viscerales, como el pulmón, manipulan circuitos neuronales entre el cuerpo y el cerebro para suprimir la respuesta inmunitaria y favorecer su crecimiento. La investigación, dirigida por equipos de la Universidad de Pensilvania y Yale, detalla cómo los tumores de adenocarcinoma pulmonar activan un eje sensorial-simpático que conecta las neuronas sensitivas del nervio vago con regiones cerebrales clave y, posteriormente, con el sistema nervioso simpático. Así, se genera un microambiente tumoral favorable al cáncer y hostil a la inmunidad.
“Cómo el tejido canceroso se comunica con el cerebro, y en ese circuito, el nervio vago suprime la respuesta inmunitaria al tumor. Otra vía más por la que el cáncer combate o secuestra nuestro sistema inmunitario”, expresó el reconocido científico estadonunidense, Eric Topol en su cuenta de X, resumiendo el impacto del hallazgo, en referencia a la investigación de Nature.
El estudio se sustenta en modelos animales modificados genéticamente, trazadores neuronales y secuenciación de ARN unicelular. Los autores identificaron que los tumores pulmonares presentan una abundante inervación, especialmente de neuronas sensoriales que expresan los receptores NPY2R y TRPV1.

Estas neuronas intervienen en la regulación inmunológica del entorno tumoral. La eliminación genética de estos subtipos neuronales en ratones con cáncer de pulmón produjo una reducción drástica del crecimiento tumoral. Este resultado se vincula con la observación clínica de que pacientes con cáncer de pulmón no microcítico cuyos tumores expresan altos niveles de TUBB3, UCHL1 o TRPV1 presentan tasas de supervivencia más bajas.
El mecanismo descrito, según detalla la investigación, muestra que los tumores liberan factores neurotróficos, como el factor de crecimiento nervioso (NGF), que promueven el desarrollo de terminaciones sensoriales del nervio vago dentro del tumor.
Estas neuronas transmiten señales al tronco encefálico, activando un circuito que culmina en el núcleo rostral ventrolateral de la médula (RVLM). Desde ese punto, se incrementa la actividad simpática dirigida al microambiente tumoral, generando la liberación de noradrenalina. Según se detalla en el esutdio, esta actúa sobre los macrófagos alveolares a través de receptores adrenérgicos β2 (ADRB2), induciendo un estado inmunosupresor. El efecto se refleja en un aumento de macrófagos con la enzima ARG1 y una disminución de células T citotóxicas, debilitando la vigilancia inmunológica frente al tumor.
El abordaje experimental incluyó la desactivación selectiva de subtipos neuronales mediante estrategias genéticas y químicas, como la administración de toxina diftérica o resiniferatoxina en los ganglios nodosos vagales.
Los ratones tratados presentaron una reducción significativa del peso tumoral y una mejora en la supervivencia. Además, la alteración del circuito sensorial-simpático, mediante inhibición farmacológica o edición genética de la vía adrenérgica β2, provocó cambios profundos en el microambiente inmune que bloquearon el crecimiento tumoral, según el estudio. En contraste, la activación de este eje mediante agonistas como el salbutamol por aerosol restauró la progresión tumoral incluso sin señal vagal sensitiva.
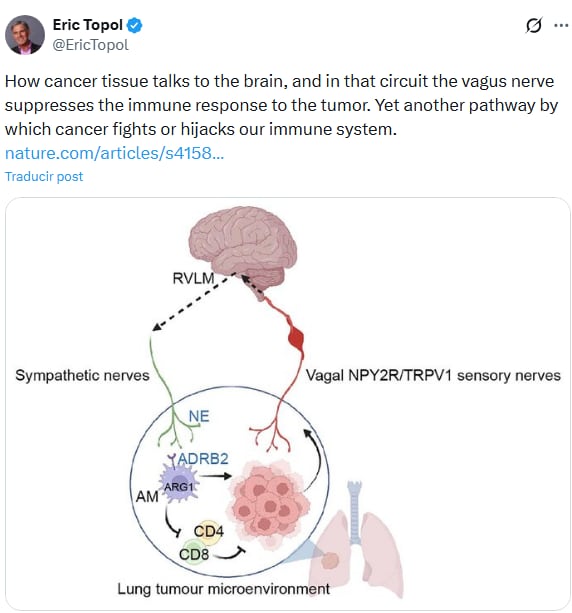
Uno de los hallazgos centrales del estudio de Nature es que la inmunosupresión observada depende de los macrófagos alveolares y de la señalización por ADRB2.
Experimentos en ratones quiméricos, en los que solo los macrófagos carecían de este receptor, demostraron que sin ADRB2 en estos fagocitos, la desactivación del circuito vago-simpático dejaba de tener impacto sobre el tumor o sobre la respuesta de las células T. Según los autores: “La señalización adrenérgica β2 en macrófagos alveolares es necesaria y suficiente para la inmunosupresión estimulada por el circuito sensorial-simpático”.
El análisis de datos clínicos en humanos aporta una dimensión translacional relevante: pacientes cuyos tumores presentan firmas transcriptómicas de alta actividad sensorial vagal y simpática tienen peor pronóstico y menor infiltrado de linfocitos T CD8. En consecuencia, el bloqueo farmacológico de los receptores adrenérgicos β surge como una posible estrategia terapéutica para potenciar la inmunidad antitumoral en cánceres viscerales como el de pulmón.
Los expertos dicen que el hallazgo exige reconsiderar la relación entre el sistema nervioso periférico y el desarrollo tumoral. Ciertos tumores parecen capaces de secuestrar circuitos neuronales internos para frenar la acción de los linfocitos encargados de detectarlos y destruirlos.
“Estos resultados revelan una comunicación bidireccional entre tumor y cerebro, mediada por un eje sensorial del nervio vago y una salida simpática, que cooperan para regular la inmunidad contra el cáncer”, concluyen los autores, quienes postulan el circuito tumoral-cerebro como nueva diana para futuras inmunoterapias.
Las próximas investigaciones analizarán si este mecanismo opera en otros órganos y tipos de cáncer, y buscarán desarrollar ensayos clínicos con fármacos que bloqueen específicamente la vía β2 adrenérgica en contextos oncológicos, con el objetivo de mejorar la supervivencia y el control inmunológico de los pacientes.
El trabajo representa un avance en la comprensión de cómo los tumores utilizan autopistas invisibles del sistema nervioso para escapar de los sistemas de defensa y motiva el desarrollo de estrategias para interrumpir esa comunicación en beneficio del paciente.